申报注册的产品已经列入《总局关于发布医疗器械分类目录的公告》(2017年第104号)的附件《医疗器械分类目录》,且管理类别为第二类。(注:对新研制的尚未列入分类目录的医疗器械,申请人可以直接向国家食品药品监督管理总局申请第三类医疗器械产品注册委托其他企业生产....
国产二类医疗器械注册办理条件
- 申报注册的产品已经列入最新版《医疗器械分类目录》,且管理类别为第二类;
- 申请人应当是依法进行登记的企业;
- 申请人建立与产品研制、生产有关的质量管理体系,并保持有效运行;
- 申请人申请注册,应当遵循医疗器械有效基本要求,保证研制过程规范,所有数据真实、完整和可溯源。
国产二类医疗器械注册申请材料清单
- 医疗器械注册申请表
- 证明性文件
- 医疗器械安全有效基本要求清单
- 综述资料
- 研究资料
- 生产制造信息
- 临床评价资料
- 产品风险分析资料
- 产品技术要求
- 产品注册检验报告
- 产品说明书和最小销售单元的标签样稿
- 符合性声明
国产二类医疗器械注册办理依据
-
- 法律法规名称:《医疗器械监督管理条例》
- 依据文号:2017年国务院令第680号修订第十一条、第十二条、第十三条
-
- 法律法规名称:《医疗器械注册管理办法》
- 依据文号:2014年国家食品药品监督管理总局令第4号 第五条、第三十六条
-
- 法律法规名称:国家药品监督管理局关于同意开展医疗器械注册人制度试点工作的批复
- 依据文号:国药监函〔2018〕42号第一条
-
- 法律法规名称:广东省食品药品监督管理局关于印发《广东省医疗器械注册人制度试点工作实施方案》的通知
- 依据文号:粤食药监局许〔2018〕77号
信智认证相关服务
| 产品分类确认或申报 |
注册单元确认 |
创新医疗器械申报 |
| 产品技术要求确认 |
产品样品送检文件准备 |
产品送检及检验报告跟踪 |
| 生产厂房规划及平面图设计 |
产品研发过程辅导 |
生产设备及检验设备、设施清单确定 |
| 无菌或无尘厂房设施验证 |
灭菌工艺验证 |
包装工艺验证 |
| 特殊过程验证 |
注册资料申报 |
注册资料递交 |
| 人员培训 |
体系考核申报资料准备 |
何等考核申报资料递交 |
| 质量管理体系文件编制 |
产品技术文档建立 |
体系考核现场检查预检查 |
| 体系考核后不符合项改善 |
注册资料发补 |
临床试验CRO |
| 临床试验备案 |
注册人制度质量协议审核 |
注册人制度受托方合同审核 |
| 委托方合规性审核 |
企业委托设计 |
产品注册专家答辩资料准备 |
| 产品注册专家答辩模拟 |
与政府主管机构联络及技术咨询 |
|
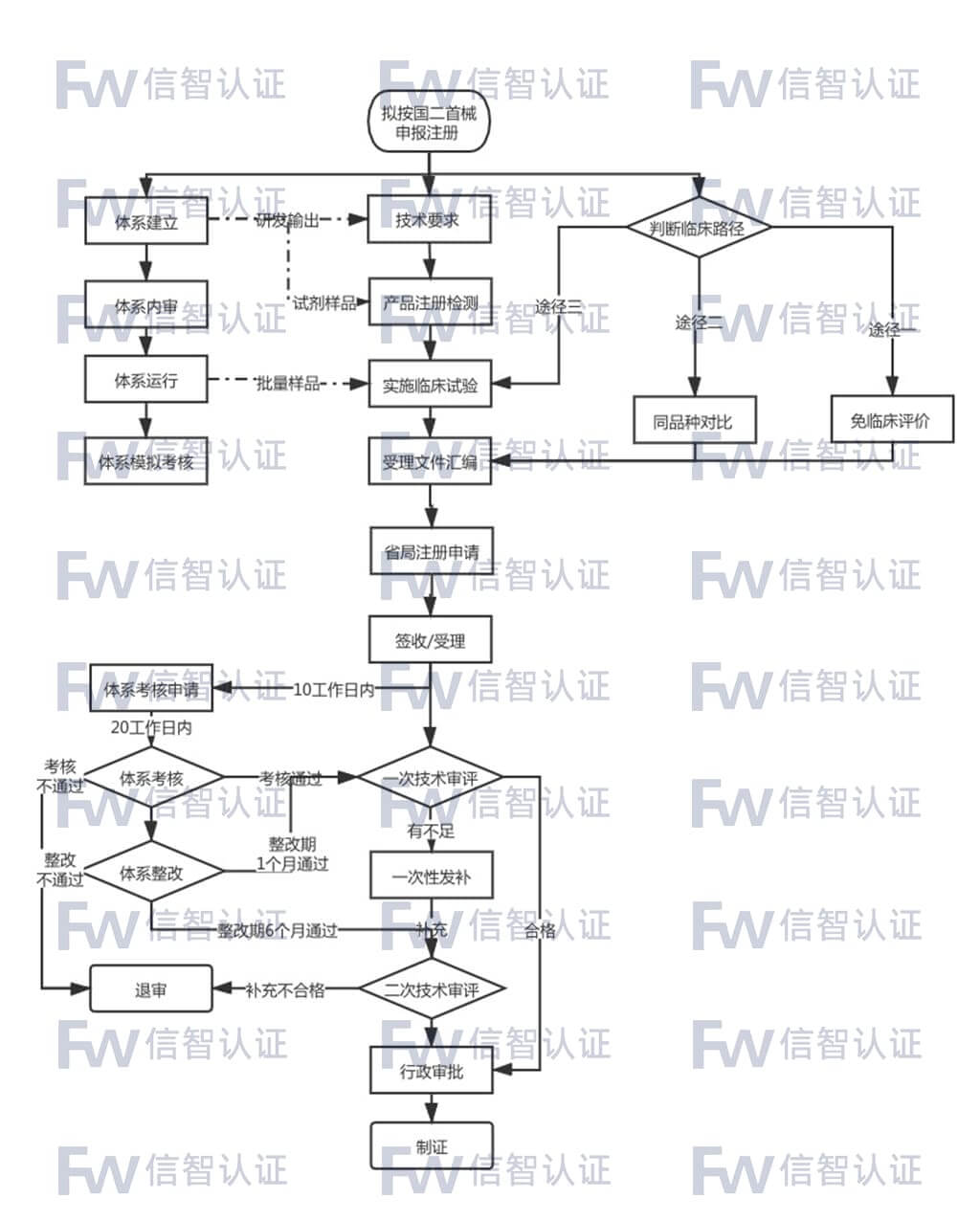
国产二类医疗器械注册咨询服务流程
国产二类医疗器械注册官方收费
| 主管部门 |
管理类别 |
首次注册 |
变更注册 |
延续注册 |
临床试验申请费 |
相关文件 |
实施日期 |
| 五年一次 |
| (万元) |
(万元) |
(万元) |
| 国家局 |
境外 |
III |
30.88 |
5.04 |
4.08 |
4.32 |
国家局2015年第53号 |
2015/5/27 |
| II |
21.09 |
4.2 |
4.08 |
/ |
| 境内 |
III |
15.36 |
5.04 |
4.08 |
4.32 |
| 省局 |
1 |
福建 |
II |
5.77 |
2.42 |
2.39 |
/ |
闽价费(2018)187号 |
2015/9/20 |
| 2 |
江西 |
II |
5.467 |
2.289 |
2.268 |
/ |
赣发改收费(2020)73号 |
2020/2/6 |
| 3 |
上海 |
II |
6.573 |
2.751 |
2.73 |
/ |
上海市局2018年第79号 |
2018/10/1 |
| 4 |
海南 |
II |
8.3 |
3.44 |
3.41 |
/ |
琼价费管【2016】38号 |
2016/3/2 |
| 5 |
山东 |
II |
8.22 |
3.44 |
3.41 |
/ |
鲁价费函(2016)13号 |
2016/4/1 |
| 6 |
内蒙古 |
II |
免征 |
免征 |
免征 |
/ |
内发改费字(2019)773号 |
2019/9/17 |
| 7 |
北京 |
II |
免征 |
免征 |
免征 |
/ |
京发改(2019)569号 |
2019/4/26 |
| 8 |
安徽 |
II |
5.005 |
2.093 |
2.097 |
/ |
皖发改价费函(2019)361号 |
2019/10/23 |
| 9 |
浙江 |
II |
6.573 |
2.751 |
2.73 |
/ |
浙政办发【2018】99号 |
2018/8/1 |
| 10 |
陕西 |
II |
免征 |
免征 |
免征 |
/ |
陕财税(2019)26号 |
2020/1/14 |
| 11 |
吉林 |
II |
免征 |
免征 |
免征 |
/ |
吉政发(2020)4号 |
2020/2/8 |
| 12 |
河北 |
II |
7.23 |
3.03 |
3 |
/ |
冀价行费【2016】210号 |
2016/11/11 |
| 13 |
江苏 |
II |
5.915 |
2.471 |
2.457 |
|
苏发改收管发【2019】91号 |
2018/12/19 |
| 14 |
宁夏 |
II |
1.5 |
0.65 |
0.65 |
/ |
2019年 第29号 |
2020/1/1 |
| 15 |
黑龙江 |
II |
5.76 |
2.416 |
2.4 |
/ |
黑政办规(2017)33号 |
2017/8/1 |
| 16 |
广东 |
II |
5.726 |
2.394 |
2.38 |
/ |
粤发改价格函(2019)666号 |
2019/2/18 |
| 17 |
湖南 |
II |
5.04 |
2.114 |
2.1 |
/ |
湘发改价费(2019)224 |
2019/3/29 |
| 18 |
天津 |
II |
免征 |
免征 |
免征 |
/ |
津党发(2018)39号 |
2019/1/4 |
| 19 |
贵州 |
II |
4.29 |
1.76 |
1.76 |
/ |
黔发改收费(2017)1589号 |
2017/10/17 |
| 20 |
四川 |
II |
3.95 |
1.65 |
1.65 |
/ |
川发改价格(2019)491号 |
2019/12/1 |
| 21 |
重庆 |
II |
免征 |
免征 |
免征 |
/ |
渝府办发(2019)56号 |
2019/5/10 |
| 22 |
广西 |
II |
7.57 |
3.16 |
3.14 |
/ |
桂价医函(2017)536号 |
2017/5/15 |
| 23 |
云南 |
II |
4.28 |
1.75 |
1.75 |
/ |
云价收费函(2018)17号 |
2018/3/16 |
| 24 |
辽宁 |
II |
5 |
2.1 |
2.1 |
/ |
辽药监告(2020)23号 |
2020/7/1 |
| 25 |
湖北 |
II |
免征 |
免征 |
免征 |
/ |
鄂政发(2016)36号 |
2016/7/26 |
| 26 |
河南 |
II |
免征 |
免征 |
免征 |
/ |
--- |
--- |
| 27 |
山西 |
II |
4.232 |
1.628 |
1.628 |
/ |
晋发改收费(2020)86号 |
2020/4/1 |